近赤外線線レーザー。
経験的になんですが、目元周り打つと「ドライアイ」が、軟口蓋に打つと「いびき」が解消されます。
論文も散見されますね。
新たな治療方法になるかもなあ。
クリニックF スマイルリフトのブログはこちらから
https://takahirofujimoto.com/blog/blog/laser-ipl-rf-plasma-ebmd/smilelift/

 藤本幸弘オフィシャルブログ
藤本幸弘オフィシャルブログ
近赤外線線レーザー。
経験的になんですが、目元周り打つと「ドライアイ」が、軟口蓋に打つと「いびき」が解消されます。
論文も散見されますね。
新たな治療方法になるかもなあ。

クリニックF スマイルリフトのブログはこちらから
https://takahirofujimoto.com/blog/blog/laser-ipl-rf-plasma-ebmd/smilelift/
集英社UOMO 2023年11月号ですが、「美容医療に懸ける時が来た」の特集でご取材いただきました。



20年以上肌の診療をしてきて思ったこと。
若造りするのではなく、それぞれの年代に合った綺麗な肌を作ること。
自然で清潔感のある肌を得ることが、僕は最も大切だと思うので、そこをひたすら追求しているんですよね。
そんなわけでクリニックFは、ヒアルロン酸注射やボトックスなどの、顔を造る施術はやめて、レーザー、光、ラジオ波などのエネルギーメディカルデバイスのみで、肌質を改善することに限定しています。
加齢すると、肌のターンオーバーが遅くなり、キメが整わなくなったり、メラニンを排出できなくなり、肌にくすみを感じる様になります。
さらにコラーゲンやエラスチン線維が細くなり、皮下に隙間ができます。その隙間に朝は水が溜まるので浮腫み、夕方にはそれらが排出されて緩みます。さらに加齢すると皮下脂肪の支持組織が伸びてしまう。
ターンオーバーを速くする波長で肌の透明感を上げて、コラーゲンエラスチンを増生させて太くする波長で肌のハリを戻す。皮下脂肪の中の支持組織を限定して縮める。
基本的に顔全面の治療ばかりです。
2016年の5月に書いた、懐かしいけど今でも役立つ記事。
紫外線防止のガラスでは、日焼けに関わる紫外線はカットできないと言う話です。
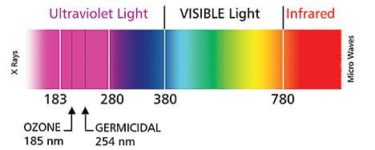
「紫外線と可視光線の境」
https://takahirofujimoto.com/blog/blog/lasertreatment/post_13000/
皮膚の色を決定している要素は、茶色いメラニンと赤いヘモグロビンです。
透明感の高い肌を得るためには、赤と茶色の要素を少しでも減らせばよいわけです。
次回の学会では医学系では珍しいLBOを使った症例を発表しますので知識の整理です。
ちょっと工学レーザーの話も入れますね。
赤みがある皮膚疾患の治療には、血管性レーザーが一般的に使用されます。
このタイプのレーザーは、血管内のヘモグロビンに反応して血管を破壊することで、血管拡張や血管網の病気を治療することができます。
代表的な血管性レーザー機器としては、以下のものがあります。
〇パルスダイレーザー(PDL):(595nm・585nm)主に顔の表面にある赤みを治療するために使用されます。
表皮を保護しながら血管内に光を照射し、血管内のヘモグロビンを破壊することで赤みを軽減します。
表皮を保護しながら血管内に光を照射し、血管内のヘモグロビンを破壊することで赤みを軽減します。
〇Nd:YAGレーザー:(1064nm)深い位置にある血管を治療するために使用されます。
表面の皮膚を通過して深い位置にある血管に光を照射し、血管を破壊することができます。
このうち、1064nmのNd:YAGレーザーの半分の波長532nmを作りだすことで、より浅い部位にあるヘモグロビンを破壊することができるのですが、それには非線形結晶を使います。
レーザー光の波長を変換するために使用される結晶です。
代表的なものは、KTP、KDP、DKDP、ADP、β-BBO、CBO、YCOB、GdCOB、GdYCOB、LiNO3、AgGaSe、KTA、CLBO、LBO、LB4、KN、AgGaS等いろいろな種類が多いのですが、
532nmを作る際には以下の三種類の結晶が使われることが多いです。
KTP結晶(ポタッシウム・チタン・リン酸塩 Potassium Titanyl Phosphate)
KTP結晶は、非線形光学結晶の中でも最も一般的に使用されているものの一つです。
Nd:YAGレーザーからの1064nmの光が入射すると、結晶内の非線形光学効果によって2倍の周波数(532nm)に変換されます。
KTP結晶は高い変換効率を持ち、安定性も高いため、広く使用されています。
BBO結晶(β-バリウムボロ酸 β-Barium Borate)
BBO結晶は、KTP結晶と同様に非線形光学結晶の一つです。
Nd:YAGレーザーからの1064nmの光が入射すると、結晶内の非線形光学効果によって2倍の周波数(532nm)に変換されます。
KTP結晶に比べて変換効率は低いですが、より広い波長範囲で使用できることが特徴です。
LBO結晶(リチウム三線酸ボロ酸エチル Lithium Triborate Ethyl)
LBO結晶は、KTP結晶やBBO結晶と同様に非線形光学結晶の一つです。
Nd:YAGレーザーからの1064nmの光が入射すると、結晶内の非線形光学効果によって2倍の周波数(532nm)に変換されます。
KTP結晶に比べて変換効率は高く、さらに高出力にも耐えることができます。
これらの非線形結晶を使用した第二高調波発生器は、Nd:YAGレーザーのような近赤外線領域で効率的に動作することができ、レーザー加工、医療用途、通信、環境モニタリングなど様々な分野で使用されています。
人工的に作られた光であるレーザーは、人類で最も偉大な発明の一つと言われるようになりました。
機器が完成したのは1960年。
僅か63年の歴史しかありません。
幸か不幸か、スターウォーズのレーザー砲や、ライトセーバーは未完成ですけれどね。(笑)
画像はwikiよりお借りしました。

明日出発の米国レーザー医学会に向けて、満員のクリニックF外来奮闘中。
今回の発表は①三菱商事の子会社で新たに開発された細胞成長因子を持った化粧品原材料AOHを用いている共同研究です。

高侵襲性のCO2フラクショナル照射後のダウンタイムを短くするために、照射後に、
①生物学的活性をもった低出力レーザーを照射する。
②AOHを塗布する。
③強力なラジカルスキャベンジャー(抗酸化物質)であるフラーレンを塗布する。
という比較検証実験。
レーザー照射の後に、別の波長のレーザーを使って炎症を止めるという発想は面白くないですか?集中して思考をまとめているのが科学者としては一番楽しいです。















